Gooi je oude lesboek maar weg. Een piramidevormig koolstofmolecuul dat een van de meest basale scheikundelessen die je op school leert tegenspreekt is voor het eerst onderzocht. Het bevat een koolstofatoom dat bindt met zes andere atomen, in plaats van de vier waarvan je geleerd hebt dat het het maximale aantal is voor koolstof.
Atomen vormen moleculen door elektronen te delen. Koolstof heeft vier elektronen die het kan delen met andere atomen. In bepaalde situaties kan deze limiet van koolstof opgerekt worden, zegt Moritz Malischewski, een scheikundige aan de Freie Universität Berlin die het molecuul genaamd hexamethylbenzeen maakte en bestudeerde.
Van stuurwiel naar piramide
Normaal gesproken lijkt dit molecuul op een stuurwiel. Het bestaat uit zes koolstofatomen die een hexagonale ring vormen met extra koolstofatomen die als armen aan de buitenkant van de ring uitsteken. In een experiment in 1973 haalden Duitse scheikundigen twee van de elektronen van de structuur weg. Deze positief geladen variant van het molecuul stortte vervolgens in en vormde een piramide. In deze schikking zijn er zes elektronen beschikbaar om de top van de piramide te verbinden met de vijf koolstofatomen in de rest van de ring en de extra arm, zegt Malischewski. Maar niemand had de vorm van het molecuul ooit gecontroleerd, tot nu.
test 1 - Center images in content - premiumbericht
Lorem ipsum odor amet, consectetuer adipiscing elit. Curabitur netus elit tortor iaculis cras. Metus arcu dictum duis placera ...
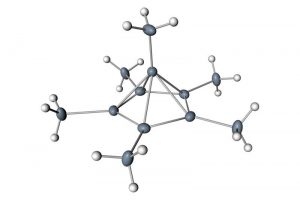
Het is een ongebruikelijke, onstabiele compositie die alleen kan bestaan bij lage temperaturen in extreem zure vloeistoffen. Malischewski heeft daarom zes maanden zitten prutsen met een krachtig zuur om het mengsel te produceren en een paar milligram van het kristal te bemachtigen. Dat kon daarna bekeken worden met röntgenstraling.
Het patroon dat ontstond doordat de röntgenstraling om het molecuul heen boog, toonde onmiskenbaar een vijfzijdige piramide.
Quantumberekeningen en andere experimenten deden al vermoeden dat een zesvoudige koolstofverbinding mogelijk was, maar de kristalstructuur is fotografisch bewijs, zegt Dean Tantillo van de universiteit van Californië. ‘Het maakt de aard van de verbindingen duidelijk en toont de beperkingen van ons begrip over organische chemische structuren’, zegt hij.
Bij een normale temperatuur en luchtvochtigheid breken de moleculen meteen af. Het is dus onwaarschijnlijk dat ze een praktische toepassing hebben zoals voor het produceren van nieuwe soorten koolstofnanobuisjes.
Maar Malischewski zegt dat hij enkel geïntrigeerd was door de vraag of het molecuul kon bestaan. ‘Het gaat om de uitdaging en de kans om scheikundigen te verbazen met wat er mogelijk is’, zegt hij.
Altijd op de hoogte blijven van het laatste wetenschapsnieuws? Meld je nu aan voor de New Scientist nieuwsbrief.
Lees verder:

