Wetenschappers werken dag en nacht om de biologische eigenschappen van het nieuwe coronavirus in kaart te brengen. Ze willen met name weten hoe het covid-19-virus menselijke cellen infecteert. Dit zijn enkele nieuwe inzichten die zullen helpen om behandelingen te ontwerpen waarmee we infecties kunnen stoppen.
Het covid-19-virus is de nieuwste vijand van de mens, die potentieel miljoenen levens kan eisen. Om dit nieuwe coronavirus onder controle te krijgen, moeten we het eerst begrijpen. Laboratoria wereldwijd werken daarom dag en nacht om de vijand beter te leren kennen.
test 1 - Center images in content - premiumbericht
Lorem ipsum odor amet, consectetuer adipiscing elit. Curabitur netus elit tortor iaculis cras. Metus arcu dictum duis placera ...
Drie cruciale vragen houden virologen met name bezig. Wat maakt het nieuwe virus zo goed in het infecteren van mensen? Hoe kan het zo snel reproduceren in ons lichaam? En waarom veroorzaakt het virus niet onmiddellijk symptomen, waardoor het ongezien kan verspreiden? De antwoorden op deze vragen zullen helpen om manieren te vinden om de ziekte te behandelen en een vaccin te ontwikkelen. Belangrijke aanwijzingen kunnen we vinden in de biologie van het virus.
Zee-egel
Net als alle virussen moet het covid-19-virus een cel infecteren om te kunnen reproduceren. Elk virus streeft ernaar om zich een cel in te wurmen en het interne mechanisme over te nemen. Vervolgens gebruikt het dit mechanisme om onderdelen te bouwen voor nieuwe virussen. Deze nieuwe virussen verlaten de cel, waar ze meer cellen kunnen infecteren – zowel in hetzelfde lichaam als in een ander.
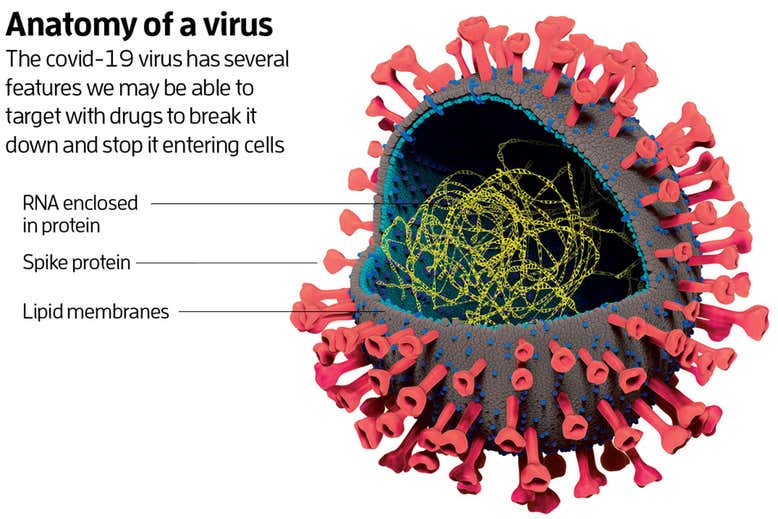
Het covid-19-virus behoort tot de familie van coronavirussen. Die zijn redelijk ingewikkeld vergeleken met andere virussen. Elk coronavirus heeft in de kern een streng RNA, een molecuul dat lijkt op DNA, waarop de genen van het virus liggen. Daaromheen ligt een eiwitmantel, omgeven door twee lagen van moleculen genaamd lipiden. Het buitenste membraan zit vol met eiwitten, waarvan sommige naar buiten steken zoals de stekels op een zee-egel.
Deze stekelige eiwitten zijn belangrijk, zegt Michael Letko van het Nationale Instituut van Allergiën en Infectieziekten in Montana. Ze functioneren als anker voor het virus: ze maken zich vast aan een eiwit aan de buitenkant van een cel.
In een onderzoek gepubliceerd op 9 maart gebruikten onderzoekers, onder leiding van Alexandra Walls van de Universiteit van Washington in Seattle, elektronmicroscopie om de moleculaire structuur van deze uitstekende eiwitten te bepalen. Met deze informatie kunnen remmende medicijnen worden ontwikkeld om de verbinding met een cel te blokkeren.
Eiwit splitsen
Een andere aanpak is om ons te richten op de eiwitten op de menselijke cellen waaraan het virus bindt. Daarvoor moeten we eerste weten welke dat zijn. Een mogelijke kandidaat is het aangrijpingspunt van het verwante SARS-virus: angiotensin-convertig enzym 2 (ACE2). Eind februari bevestigde Letko’s team dat het eiwit van het nieuwe coronavirus ook aan ACE2 bindt.
Letko acht het logisch dat ACE2 een rol speelt. ‘Dit komt tot expressie in de longen en in het spijsverteringskanaal. Daarmee kan het gedeeltelijk verklaren waarom het virus op die plekken infecteert.’
Het virus hecht zichzelf echter niet zomaar aan ACE2. Het viruseiwit splitst zichzelf eerst en zorgt daarna dat de eiwitten op de cel hetzelfde doen. Een eiwit dat hierin belangrijk is, is transmembraan protease serine 2 (TMPRSS2). Dit is door twee onderzoeken bevestigd en gepubliceerd in maart. Walls’ team heeft ook een tweede eiwit gevonden dat het viruseiwit kan splitsen, genaamd furine.
‘Deze kunnen ook als doelwitten voor medicijnen dienen’, zegt Rolf Hilgenfeld van de Universiteit van Lübeck in Duitsland. Als we deze menselijke eiwitten blokkeren met medicijnen, kan het virus niet meer in de cel komen. Hierdoor kan het eiwit echter niet meer functioneren zoals het normaal gesproken doet, wat mogelijk bijwerkingen oplevert.
Belang voor de toekomst
De binnenkomst van het virus in de cel kan ook onderbroken worden door een eiwit genaamd lymfocyt antigen 6E (LY6E). Dit eiwit is betrokken bij onze immuunreacties. In een onderzoek gepubliceerd op 7 maart toont Stephanie Pfänder van de Ruhr-Universiteit Bochum in Duitsland met haar collega’s aan dat LY6E voorkomt dat coronavirussen een cel in gaan. Dit geldt ook voor het covid-19-virus. Daarnaast blijkt dat muizen zonder LY6E gevoeliger zijn voor een infectie dan muizen die wel LY6E hebben.
Ze zegt dat als we erachter komen wat het eiwit doet, we het mogelijk ook kunnen namaken in een medicijn. Dit zou zelfs kunnen helpen tegen infecties van verschillende coronavirussen. ‘Het hebben van een coronavirusremmer zou natuurlijk ook van groot belang zijn voor toekomstige uitbraken’, zegt ze. ‘Niet alleen voor de huidige pandemie.’
Knippen
Voorkomen dat het virus de cel binnen komt is één ding. Als een persoon al geïnfecteerd is, is het ook belangrijk om het virus te belemmeren terwijl het zichzelf kopieert. Er zijn twee duidelijke punten waarop we hier kunnen aanvallen. Om te kunnen vermenigvuldigen, moet het virus eiwitten bouwen én zijn RNA kopiëren.
De eiwitten worden als eerste gemaakt. Als het virus-RNA de geïnfecteerde cel binnen komt, leest het mechanisme van de cel de genen van het virus af. Hierdoor maakt de cel twee lange ‘polyproteïnes’, waar de verschillende virale eiwitten in zitten. Sommige van deze eiwitten zijn proteases. Deze knippen zichzelf uit de polyproteïne, waarna ze de andere eiwitten er ook uit knippen. Hierna zijn de eiwitten vrij om hun functies uit te voeren.
‘Wanneer je dat knippen onderbreekt, kan het virus niet reproduceren’, zegt Hilgenfeld. Zijn team heeft de moleculaire structuur van de belangrijkste protease vastgesteld. Daarnaast heeft hij de stoffen gevonden die aan de protease binden.
Zijn groep is een remmer aan het ontwikkelen voor de belangrijkste proteases van coronavirussen en een vergelijkbare groep genaamd enterovirussen. Ze hopen dat dit medicijn daardoor breed genoeg inzetbaar is om interessant te zijn voor farmaceutische bedrijven. De onderzoekers hebben het zo aangepast dat het ook werkt op het covid-19-virus. Daarnaast toonden ze aan dat het resulterende medicijn werkt op individuele cellen. Maar er zijn nog veel testen te doorlopen voor het medicijn gebruikt kan worden op mensen die besmet zijn met het nieuwe coronavirus.
Ebolamedicijn
De andere optie is om ervoor te zorgen dat het virus zijn genoom niet kan kopiëren. Dit gebeurt door een ander viraal eiwit: RNA-dependent RNA polymerase (RdRP). De meeste RNA-virussen checken niet voor fouten tijdens het kopiëren. Hierdoor kunnen ze geblokkeerd worden door aangepaste RNA-bouwstenen in te bouwen: het RdRP bouwt deze dan gewoon in ‘mits het virus dom genoeg is’, zegt Hilgenfeld.
Helaas zijn coronavirussen, zoals het covid-19-virus, niet dom. Ze hebben een nakijkenzym, genaamd exonuclease, dat aangepaste RNA-stukken verwijdert, waardoor het kopiëren foutloos verder gaat. ‘Veel van de bestaande RdRP-remmers helpen niet tegen coronavirussen’, zegt Hilgenfeld.
Desondanks hebben onderzoekers, onder leiding van Tai Yang van het Chengdu Medische College in China, zeven stoffen ontdekt die volgens berekenen aan RdRP moeten binden. In de tussentijd geeft een medicijn genaamd remdesivir een positief vooruitzicht als RdRP-remmer. Dit middel was oorspronkelijk gemaakt om ebola te behandelen.
Immuunsysteem in de war
Op de lange termijn is het belangrijk om te weten hoe het virus zich zo makkelijk kan verspreiden. ‘De ongeziene verspreiding heeft veel bijgedragen aan de ernst van de uitbraak’, zegt Letko.
De verspreiding gaat zo snel, omdat het virus zich dagenlang kan reproduceren in onze lichamen zonder ons immuunsysteem te activeren. De meest herkenbare symptomen van covid-19 – koorts en hoesten – ontstaan doordat het immuunsysteem terugvecht. Het virus vertraagt dit echter door extra genen die het meedraagt.
Deze ‘niet-structurele genen’ coderen voor eiwitten die ons immuunsysteem dwarsbomen. Na de infectie van een cel wordt een alarmsysteem geactiveerd. ‘Het virus heeft eiwitten die dat systeem in de war brengen’, zegt Letko.
Sommige van de niet-structurele genen van het covid-19-virus lijken op bekende genen. Daardoor hebben we een vermoeden van hun functie. ‘Maar op sommige onderdelen hebben we nog niet echt grip’, zegt Letko.
In de nabije toekomst zal het begrijpen van deze eiwitten ons misschien niet helpen om de uitbraak te vertragen, maar het kan ons wel helpen met antivirale medicijnen ontwikkelen voor de verdere toekomst.

