Onderzoekers kregen het met nanotechnologie voor elkaar om CO2 bij kamertemperatuur om te zetten in iets anders. ‘We staan aan de wieg van een innovatieve en veelbelovende techniek.’
Het verlagen van de CO2-emissies staat centraal in het debat over hoe we klimaatverandering kunnen beperken. Niet alleen zoeken wetenschappers naar alternatieve, duurzame energiebronnen, ze experimenteren ook met chemische reacties die CO2 in onze industriële uitlaatgassen omzetten in een andere stof, zodat er uiteindelijk minder van het gas in de atmosfeer terechtkomt. Deze reacties kosten echter enorm veel energie.
Amerikaanse wetenschappers vonden recent zo’n reactie die bij kamertemperatuur kan plaatsvinden. In plaats van uit warmte haalden ze de benodigde energie namelijk uit nanotechnologie.
test 1 - Center images in content - premiumbericht
Lorem ipsum odor amet, consectetuer adipiscing elit. Curabitur netus elit tortor iaculis cras. Metus arcu dictum duis placera ...
‘De techniek biedt, naast het verminderen van CO2-emissies, ook kansen in de circulaire industrie’, zegt Arjan Mol, hoogleraar corrosietechnologie en elektrochemie aan de Technische Universiteit Delft en niet bij dit onderzoek betrokken. Het bijproduct is namelijk te gebruiken in andere chemische reacties.
700 graden Celsius
Om het gehalte aan koolstofdioxide in industriële uitlaatgassen te verminderen, kan het CO2-molecuul worden omgezet naar een koolstofmonoxidemolecuul (CO). Dat is dan te gebruiken in een chemisch product. Daarvoor moeten de verbindingen in het CO2-molecuul wel eerst verbroken worden.
Daar is heel veel energie voor nodig. Het vergt een temperatuur van minstens 700 graden Celsius om een van de zuurstofatomen van het CO2-molecuul af te trekken. Dit maakt het lastig om zulke reacties toe te passen in de praktijk.
Daarom besloten Renu Sharma, onderzoeker aan het National Institute of Standards and Technology, en haar team te experimenteren met een alternatieve energiebron uit de nanotechnologie.
Koolstofdonor
Sharma en collega’s gebruikten nanodeeltjes van aluminium als katalysator. Wanneer je die aanstraalt met een straal van elektronen – met een diameter van 1 tot 1000 nanometer – gaan elektronen van het aluminiumatoom in dit deeltje oscilleren. Dit levert de benodigde energie op om de binding in het CO2-molecuul open te breken en een zuurstofatoom vrij te maken.
Dan hou je één CO en één O over. Om hier twee CO-moleculen van te maken, is er een extra koolstofatoom (C) nodig dat zich als het ware vastklemt aan het vrije zuurstofatoom. Daarom vindt de reactie plaats op een extreem dun laagje grafiet. ‘Dat geeft een koolstofatoom af – als een soort koolstofdonor’, zegt Mol.
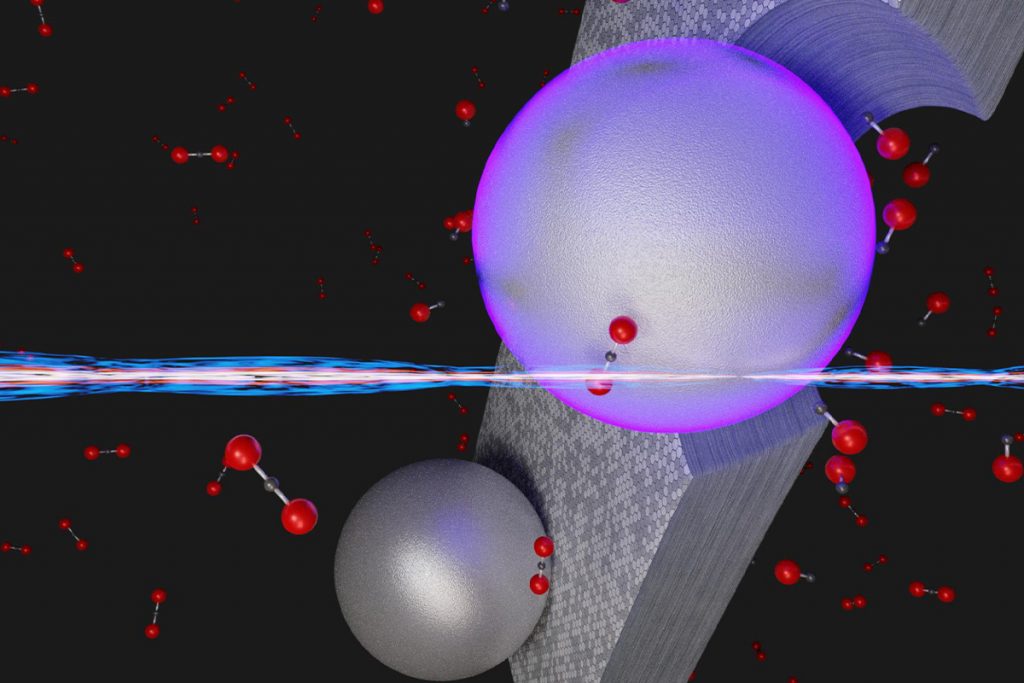
De onderzoekers zijn erin geslaagd deze reactie op kleine schaal bij kamertemperatuur te laten plaatsvinden. ‘En daarmee hebben ze baanbrekend fundamenteel werk verricht’, zegt Mol.
Circulair
De CO-moleculen die hierbij vrijkomen, zijn giftig. Maar wanneer je waterstof aan de fabrieksschoorsteen zou toevoegen, krijg je bijvoorbeeld methaan of ethanol.
De onderzoekers menen dat die stoffen vervolgens makkelijk verwerkt kunnen worden in veelgebruikte producten, zoals medicijnen, schoonmaakmiddelen en cosmetica. ‘Zo draagt deze studie niet alleen bij aan het reduceren van koolstofemissies, maar ook aan de circulaire uitdaging’, zegt Mol.
Wel is de methode nog niet toegepast bij echte industriële processen. De onderzoekers voerden het experiment uit in een gecontroleerde omgeving met afmetingen van slechts enkele nanometers.
‘Voordat de onderzoekers de techniek op grote schaal kunnen toepassen, moeten we nog veel vragen beantwoorden’, zegt Mol. ‘Maar dat is logisch; zo beginnen nieuwe doorbraken. We staan aan de wieg van een innovatieve en veelbelovende techniek.’

